PLes patients atteints de maladies inflammatoires chroniques de l’intestin (MICI) souffrent de douleurs abdominales, de diarrhées, de saignements rectaux et d’une perte de poids. À mesure que ces symptômes se développent, l’environnement cellulaire de l’intestin subit une transformation radicale. Pourtant, les scientifiques en savent peu sur le paysage géographique cellulaire de ce remodelage à mesure que la maladie progresse.
Pour cartographier spatialement ces trajectoires cellulaires dans l’intestin, une équipe de recherche, dirigée par un biologiste unicellulaire Jeffrey Moffitt de l’hôpital pour enfants de Boston et immunologiste Roni Nowarski de l’hôpital Brigham and Women’s, ont photographié les molécules d’ARN des cellules de l’intestin dans un modèle murin de colite, avant, pendant et après l’inflammation. Dans leur étude publiée dans Cellulel’équipe a montré qu’à mesure que la maladie progressait, il y avait une transformation spatiale progressive de l’intestin, partiellement façonnée par la présence et la distribution de diverses sous-populations de fibroblastes liés à l’inflammation.1 Des semaines après le retrait du médicament provoquant la colite, certains de ces fibroblastes ont conservé la mémoire de l’inflammation.
« Le contexte spatial est important en biologie », a déclaré Kylie Jamesimmunologiste des muqueuses à l’Institut de recherche médicale Garvan qui n’a pas participé à l’étude. Savoir où se trouvent les cellules dans la paroi gastro-intestinale est important pour comprendre leur rôle dans les processus inflammatoires et leur contribution à la maladie. « Traditionnellement, cette information a été perdue », a-t-elle expliqué, car les chercheurs analysent souvent ces cellules une fois qu’elles ont été retirées du tissu. précédent études ont utilisé la transcriptomique spatiale pour cartographier les signatures cellulaires au sein de l’architecture intestinale. « L’un des aspects uniques ici est qu’ils examinent également toute la trajectoire de l’inflammation, en le faisant à plusieurs moments pour comprendre comment les signatures cellulaires changent », a déclaré James.2,3
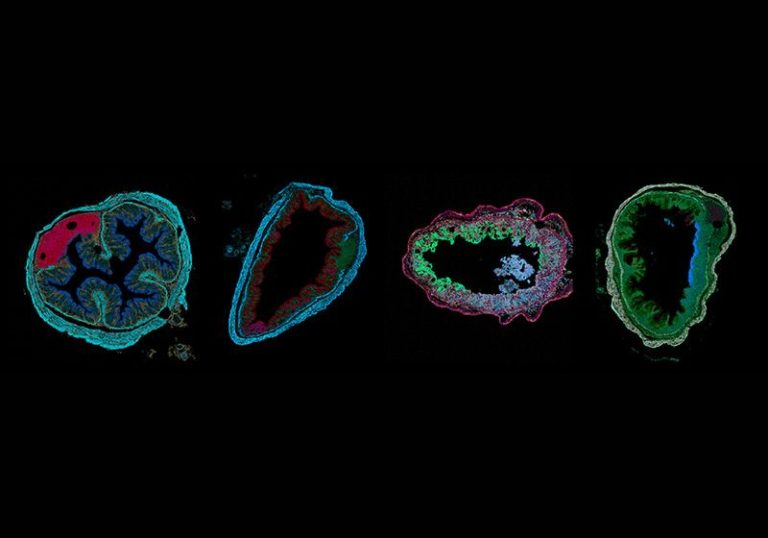
Dans cette étude, les chercheurs ont utilisé la technologie de transcriptomique spatiale Merfish (multiplexed error-robust fluorescence in situ hybridization, MERFISH) pour suivre les trajectoires d’expression génétique tout au long de la progression de la maladie. Ils ont cartographié 940 gènes dans le côlon de souris avant l’administration du médicament provoquant la colite (jour zéro), au début de la maladie (jour trois), au pic de l’inflammation (jour neuvième) et après la guérison (jours 21 et 35).
À l’aide de ces données, ils ont identifié 25 quartiers tissulaires, définis statistiquement par des collections locales récurrentes de cellules. Chaque quartier était composé d’un mélange unique de différents types de cellules, telles que des cellules épithéliales, endothéliales, immunitaires et fibroblastiques, dans des proportions spécifiques. Certains quartiers étaient présents à tous les stades (par exemple, sains et malades) tandis que d’autres étaient uniques à des moments précis.
Les chercheurs ont constaté que, à mesure que la maladie progressait, la prévalence de nombreux quartiers changeait : la présence de certains quartiers sains diminuait, tandis que certains quartiers inflammatoires émergeaient. L’une des signatures de la plupart de ces quartiers émergents de la maladie était la présence de diverses sous-populations de fibroblastes associés à l’inflammation, qui provenaient de fibroblastes sains. Les fibroblastes sont des régulateurs immunitaires clés, et plusieurs études ont déjà fait allusion à un certain degré d’hétérogénéité des fibroblastes inflammatoires au cours des MII.4,5 La présente étude a identifié des sous-populations de fibroblastes associées à l’inflammation différant en termes d’expression génétique, de localisation spatiale et de stade de la maladie auquel elles ont émergé.
« Sur le plan fonctionnel, nous ne comprenons toujours pas très bien ce que font ces différents sous-ensembles de fibroblastes », a déclaré Nowarski. « Ce que nous avons pu montrer dans ce travail, c’est qu’il existe une diversité sous-estimée de ces sous-ensembles de fibroblastes. »
Certaines de ces populations de fibroblastes ont conservé des marqueurs inflammatoires des semaines après la guérison de la colite, ce qui suggère une possible mémoire de la maladie. « C’est vraiment intéressant, car dans le contexte humain, nous pouvons voir que même lorsque les personnes sont en rémission (de MICI), leur intestin est toujours différent de celui d’un individu en bonne santé », a déclaré James. Par exemple, de nombreux patients peuvent souffrir de symptômes intermittents et imprévisibles rechutes.6 « Je pense que le type d’informations temporelles (présentées dans cette étude) peut nous aider à comprendre les MII même en l’absence d’inflammation active. »
En exploitant les données humaines publiées par d’autres groupes, Moffitt, Nowarski et leurs collègues ont trouvé des homologues humains de nombreux marqueurs moléculaires des états inflammatoires des sous-populations de fibroblastes chez les patients atteints de colite ulcéreuse. Cela suggère que le côlon humain enflammé pourrait également héberger divers sous-ensembles de fibroblastes associés à l’inflammation tout en subissant des changements similaires à ceux rapportés dans cette étude.
Les auteurs soulignent cependant que les fibroblastes ne sont pas les seules cellules en cours de transformation. « Nous observons que presque tous les types de cellules réagissent à la maladie », a déclaré le coauteur Paolo Cadinu du Boston Children’s Hospital et de la Harvard Medical School. Bien que cette conclusion puisse sembler triviale, « elle est en même temps extrêmement puissante, car elle nous indique que les futures études devraient vraiment regarder en détail, et ne pas se concentrer uniquement sur la façon dont (quelques types de cellules) participent à la maladie. »