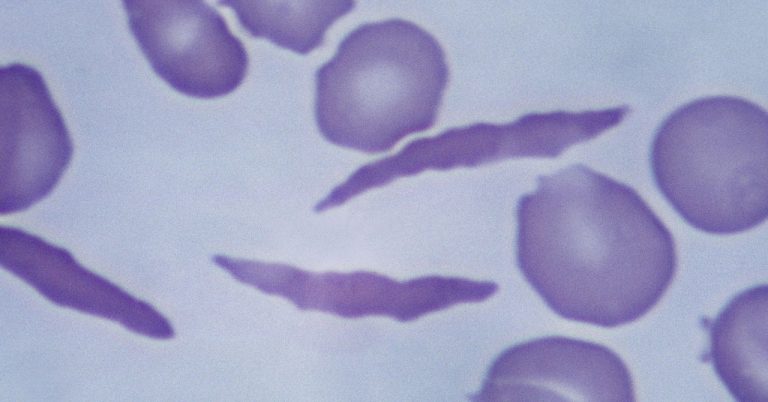
Casgevy utilise le Lauréat du prix Nobel technologie Crispr modifier les cellules des patients afin qu’elles produisent plutôt de l’hémoglobine saine. Le système Crispr comporte deux parties : une protéine qui coupe le matériel génétique et une molécule guide qui lui indique où dans le génome effectuer la coupe.
Pour ce faire, les cellules souches d’un patient sont extraites de sa moelle osseuse et éditées en laboratoire. Les scientifiques effectuent une seule coupure dans un gène différent, appelé BCL11A, pour activer la production d’une forme fœtale d’hémoglobine qui s’arrête généralement peu de temps après la naissance. Cette version fœtale compense l’hémoglobine adulte anormale. Les cellules modifiées sont ensuite réinfusées dans la circulation sanguine du patient.
Au total, 45 patients ont reçu Casgevy dans le cadre d’un essai clinique. Sur les 31 patients suivis pendant deux ans, 29 n’ont plus eu de crises douloureuses depuis au moins un an après avoir reçu une dose unique de leurs propres cellules modifiées.
Jusqu’à présent, le seul remède contre la drépanocytose était une greffe de cellules souches provenant d’un donneur étroitement apparenté, mais cette option n’est disponible que pour une petite fraction de personnes. Les greffes peuvent également comporter des risques mortels et ne fonctionnent pas toujours.
Les premiers patients commerciaux bénéficiant du Casgevy ne seront probablement pas traités avant le début de l’année prochaine. Il faut quelques semaines pour collecter les cellules des patients, les modifier et effectuer des contrôles de qualité avant que les cellules ne soient prêtes à être injectées. « Il faut un peu de temps pour traiter les patients », explique Kulkarni. « Mais nous ne voulons pas perdre de temps, et les patients ne veulent pas perdre de temps, car ils attendent cela depuis un moment. »
Aujourd’hui, la FDA a également approuvé un deuxième type de traitement génique contre la drépanocytose, appelée Lyfgenia. Cette thérapie n’utilise pas Crispr pour couper le génome, mais ajoute plutôt un gène thérapeutique aux cellules afin qu’elles puissent produire une hémoglobine saine. Fabriqué par Bluebird Bio de Somerville, Massachusetts, il implique également de modifier les cellules des patients en dehors du corps. Au cours d’un essai de deux ans, les crises douloureuses ont été éliminées chez 28 patients sur 32 entre six et 18 mois après le traitement par Lyfgenia.
La FDA a placé une boîte noire d’avertissement sur Lyfgenia, une indication de risques graves pour la sécurité, car certains patients traités avec ce médicament ont développé un cancer du sang. L’agence affirme que les patients qui en reçoivent doivent être surveillés pour le reste de leur vie.
Alexis Thompson, chef de la division d’hématologie à l’hôpital pour enfants de Philadelphie, affirme que ces nouvelles thérapies géniques transformeront la vie des patients. «Je peux désormais parler aux parents de la possibilité que leur enfant soit peut-être guéri de la drépanocytose», dit-elle. «Il y a quelques années, je n’oserais pas avoir cette conversation avec une famille.»