LAvec leur pouvoir d’auto-renouvellement et de multipotence, les cellules souches mésenchymateuses (CSM) offrent la possibilité de traitement régénératif pour diverses pathologies, notamment les lésions de la moelle épinière et les dommages consécutifs à une crise cardiaque.1
L’une des principales hypothèses est que les avantages thérapeutiques des CSM sont conférés par leur sécrétion de vésicules extracellulaires (VE) : des structures dérivées de la membrane qui contiennent une variété de molécules bioactives.2 Les cellules thérapeutiques comme les cellules souches mésenchymateuses (CSM) produisent des électrons variables, ce qui contribue à des résultats incohérents qui entravent leur application clinique. Pourtant, les scientifiques ne sont pas en mesure de sélectionner des cellules en fonction de leurs niveaux de sécrétion d’électrons.
« Comment savez-vous combien de vésicules extracellulaires sécrètent les cellules souches mésenchymateuses ? Comment savez-vous que ce lot de cellules est meilleur que celui-ci ? » a demandé Dino Di Carlobio-ingénieur à l’Université de Californie à Los Angeles.
Dans une nouvelle étude publiée dans Nature CommunicationsDi Carlo et ses collègues ont appliqué leur expertise en microfluidique et en nanotechnologie pour répondre à ces questions.3 Ils ont développé une méthode pour identifier les sous-populations de MSC qui sécrètent des niveaux élevés d’EV, une approche qui pourrait permettre la sélection de cellules plus actives sur le plan thérapeutique pour des applications cliniques.
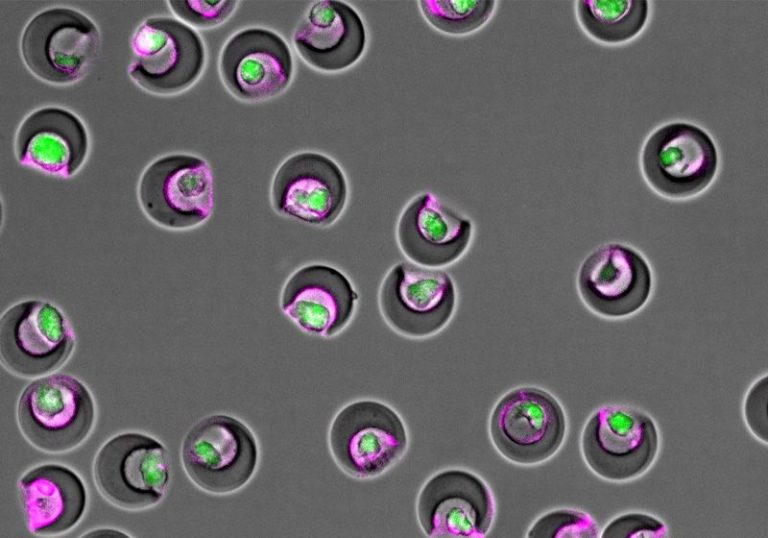
Auparavant, Di Carlo et son équipe ont développé des microconteneurs à base d’hydrogel, qu’ils ont appelés nanofiolesqui servent de tubes à essai pour les cellules individuelles.4 En recouvrant l’intérieur des nanofioles en forme de bol d’anticorps spécifiques aux protéines libérées par une cellule d’intérêt, les chercheurs ont pu capturer des cellules individuelles et quantifier leurs sécrétions. Dans une étude antérieure, l’équipe a utilisé cette technologie pour mesurer la sécrétion de protéines de cellules B individuelles, qu’elle a ensuite reliée à des marqueurs de surface cellulaire et à des données d’expression génétique de la même cellule.
Lorsque Di Carlo a entrepris de mesurer la sécrétion d’EV à partir de MSC individuelles, il a découvert que ce n’était pas aussi simple.
« Le premier défi était que la mesure des vésicules extracellulaires sécrétées est un peu différente de la mesure des protéines sécrétées », a fait remarquer Di Carlo. « Les vésicules extracellulaires sont beaucoup plus grandes (et) elles (expriment) également certaines protéines et marqueurs de surface cellulaire courants. »
L’équipe de Di Carlo avait besoin d’identifier des marqueurs qui pourraient être utilisés pour colorer les EV sécrétés, mais pas les cellules qui les sécrètent. Ils savaient que les protéines d’échafaudage liées à la membrane appelées tétraspanines étaient de bons marqueurs des EV, mais certaines d’entre elles pouvaient également être exprimées par les MSC. Après avoir évalué plusieurs combinaisons, ils ont opté pour des cibles doubles : CD63 et CD9. Ces tétraspanines sont exprimées en combinaison à la surface des EV, mais les cellules qui sécrètent les EV n’expriment que l’une ou l’autre.
En tapissant leurs tubes à essai microscopiques d’anticorps anti-CD63, ils ont posé l’appât pour toute cellule exprimant le marqueur. Cependant, l’ajout d’anticorps anti-CD9 a permis de garantir qu’ils ne capturaient que les EV. En utilisant cette approche sur des cellules souches embryonnaires immortelles uniques (iMSC), ils ont découvert que certaines cellules libéraient beaucoup plus d’EV que d’autres.
« C’est très excitant », a déclaré Joy Wolframun nanoscientifique de l’Université du Queensland spécialisé dans l’application thérapeutique des vésicules extracellulaires et qui n’a pas participé à ce travail. « Cette étude montre que même s’il s’agit de la même lignée cellulaire, il existe toujours cette hétérogénéité. »
Wolfram a expliqué que les cellules souches mésenchymateuses humaines primaires présenteraient une disparité encore plus grande dans la sécrétion d’EV en raison des différences génétiques et du mode de vie des donneurs. « Pouvoir mettre en œuvre une méthode à haut débit pour capturer les cellules donneuses idéales, qui pourraient varier en fonction de l’application, c’est quelque chose qui nous intéresse beaucoup. Comment pouvons-nous en tirer parti et sélectionner les clones optimaux, voire les donneurs humains, pour ce type de thérapie ? », a commenté Wolfram.
L’équipe a également identifié plusieurs caractéristiques clés des cellules hautement sécrétrices capturées : elles présentaient une prolifération accrue, maintenaient le phénotype hautement sécréteur sur plusieurs générations et conservaient leur multipotence. Cela a permis aux chercheurs d’identifier des candidats thérapeutiques puissants, puis d’enrichir ces cellules.
L’objectif de l’équipe de Di Carlo étant d’améliorer les résultats cliniques des thérapies régénératrices à base de cellules souches mésenchymateuses (CSM), elle a voulu tester sa méthode dans un modèle in vivo. Pour ce faire, elle a sélectionné des populations de CSM primaires de souris à sécrétion élevée et faible et a comparé leur efficacité thérapeutique dans un modèle murin d’infarctus du myocarde (crise cardiaque). Vingt-huit jours après le traitement, les souris ayant reçu une injection de CSM à sécrétion élevée ont affiché des taux de régénération vasculaire plus élevés et une fonction cardiaque améliorée par rapport à celles ayant reçu une injection de cellules à sécrétion faible.
Di Carlo et son équipe poursuivent des études précliniques sur les lésions myocardiques chez le porc, le grand modèle animal privilégié pour la recherche cardiovasculaire. Ils explorent également d’autres applications thérapeutiques potentielles des sécréteurs importants, un enthousiasme partagé par Wolfram.
« Ce n’est qu’un début en ce qui concerne les applications futures qui peuvent découler de cette technologie », a déclaré Wolfram. « Si nous découvrons qu’un certain type de VE est plus thérapeutique, nous pourrions utiliser la même technologie pour sélectionner les cellules qui libèrent ce type. »
Références
1. Kou M, et al. Vésicules extracellulaires dérivées de cellules souches mésenchymateuses pour l’immunomodulation et la régénération : un outil thérapeutique de nouvelle génération ? Maladie de la mort cellulaire. 2022;13(7):580.
2. Cheng L, Hill AF. Exploiter les vésicules extracellulaires à des fins thérapeutiques. Découverte de médicaments Nat Rev. 2022;21(5):379-399.
3. Koo D, et al. Optimisation de la thérapie cellulaire par le tri des cellules à forte sécrétion de vésicules extracellulaires. Commune nationale. 2024;15(1):4870.
4. Cheng RY-H, et al. SEC-seq : Association des signatures moléculaires avec la sécrétion d’anticorps dans des milliers de plasmocytes humains individuels. Commune nationale. 2023;14(1):3567.