jeDans les premiers stades du développement embryonnaire humain, un zygote se divise en deux cellules totipotentes qui deviennent finalement huit cellules.1 Les décisions sur le sort des cellules commencent à différencier cette population totipotente en lignées spécifiquesdonnant naissance au blastocyste.2 C’est du moins le modèle de travail. Maintenant, une nouvelle étude Publié dans Cellule suggère que ce n’est peut-être pas toute l’histoire.3
« Ils ne sont pas identiques », a déclaré Magdalena Zernicka-Goetz, biologiste du développement et des cellules souches au California Institute of Technology et à l’Université de Cambridge et coauteur de l’étude. « Une seule des deux cellules est véritablement totipotente, c’est-à-dire qu’elle peut donner naissance au corps et au placenta, et la seconde cellule donne principalement naissance au placenta. » Les résultats aident à élucider ce qui se passe au cours des premières périodes du développement.
« J’ai toujours été intéressée par la façon dont les cellules décident de leur sort », a déclaré Zernicka-Goetz. Dans l’embryon en développement de souris, elle a déjà démontré un biais au stade bicellulaire : une cellule contribuait davantage au tissu fœtal et l’autre au placenta.4
« Nous savons si peu de choses sur les tout premiers stades du développement humain », a déclaré Nicolas Plachtabiologiste du développement à l’Université de Pennsylvanie qui n’a pas participé à l’étude.
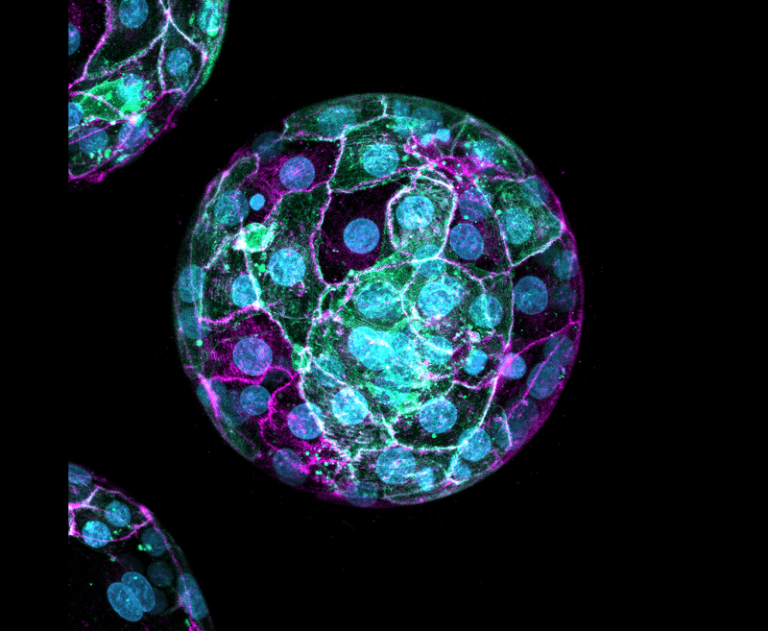
Pour mieux comprendre ce processus, Zernicka-Goetz a cherché à savoir si le développement embryonnaire humain ressemblait à celui de la souris. Elle et son équipe ont d’abord suivi la lignée cellulaire à partir du stade à deux cellules ; ils ont injecté l’ARNm de la protéine fluorescente verte (GFP) fusionné à une séquence de trafic membranaire dans l’une des deux cellules du zygote. Ainsi, ils pourraient déterminer la contribution de chaque cellule au développement de deux structures précoces : le trophectoderme (TE) qui devient le placenta et la masse cellulaire interne (ICM) qui produit éventuellement l’épiblaste, ou tissu fœtal, et l’hypoblaste, ou le sac vitellin.
Lorsqu’ils ont suivi l’expression de la GFP, l’équipe a découvert qu’une population de cellules dominait soit dans l’ICM, soit dans le TE, mais que ce déséquilibre était plus important dans l’ICM. Au sein de l’ICM, la descendance d’un clone au stade deux cellules dominait la population de l’épiblaste, tandis que la composition de l’hypoblaste était divisée entre les cellules des deux clones d’origine. « Cela signifie qu’au stade de deux cellules, nous avons un biais du destin cellulaire de ces deux cellules, mais ce n’est pas un processus déterministe », a déclaré Zernicka-Goetz.
Pour étudier plus en détail la contribution cellulaire à l’ICM, les chercheurs ont marqué l’ADN et l’actine et, à partir du stade huit cellules, ont suivi les positions cellulaires après division à l’aide de l’imagerie de cellules vivantes. Les divisions cellulaires asymétriques (ACD) impliquent des cellules qui s’introduisent dans la masse cellulaire en croissance plutôt que de rester à la surface, et ces cellules intérieures contribuent à l’ICM. L’équipe a observé que même si les ACD étaient globalement moins courants, leur composition ressemblait à celle de l’ICM.
Chez la souris, le clone au stade à deux cellules qui a contribué davantage à l’ICM divisé plus rapidement que la deuxième cellule, l’équipe a donc étudié si ce modèle s’appliquait ou non au développement embryonnaire humain.5 L’équipe a étudié des films d’embryons en division active et a déterminé que dans la plupart des embryons, une cellule au stade à deux cellules se divisait plus rapidement et que sa progéniture héritait également de cette caractéristique. L’équipe a également remarqué que la première cellule à subir une ACD était l’une de ces cellules à division rapide.
« Il s’agit de la première étude à effectuer un suivi cellulaire intéressant dans un embryon humain à ces premiers stades », a déclaré Platcha. Cependant, il a noté que la variabilité inhérente des embryons humains par rapport aux modèles murins établis rend difficile la conclusion dans ce domaine de recherche. Ceci est encore compliqué par le nombre limité de zygotes disponibles pour la recherche, car les cliniques préservent généralement les embryons à des stades de développement ultérieurs.
Zernicka-Goetz vise ensuite à étudier les caractéristiques et les origines des différences entre les clones au stade deux cellules.
L’œuvre de Zernicka-Goetz a été nominé par Le scientifiquec’est Soumissions au programme de profil des pairs.
Les références
- De Paepe C, et al. Les cellules du trophectoderme humain ne sont pas encore engagées. Hum reprod. 2012;28(3):740-749.
- Blakeley P, et al. Définition des trois lignées cellulaires du blastocyste humain par séquençage d’ARN unicellulaire. Développement. 2015;142(18):3151-3165.
- Junyent S, et al. Les deux premiers blastomères contribuent inégalement à l’embryon humain. Cellule. 2024;187 :1-17.
- Piotrowska K, et al. Les blastomères issus de la première division de clivage ont des destins distinctifs au cours du développement normal de la souris. Développement. 2001;128(19):3739-3748.
- Morris SA, et coll. La réponse différentielle à la signalisation Fgf dans les cellules internalisées à différents moments influence la ségrégation de la lignée dans les embryons de souris préimplantatoires. Ouvrez Biol. 2013;3:130104.