MQuelques instants après la naissance, le bébé prend sa première respiration tandis que le placenta, qui a servi de poumon au fœtus pendant la gestation, transfère la responsabilité aux propres organes du bébé. Cependant, pour les patients nés avec hernie diaphragmatique congénitale (CDH), une maladie rare dans laquelle le diaphragme ne se ferme pas, entraînant un développement pulmonaire altéré, l’entrée dans le monde est plus précaire.1 Les cas plus graves de la maladie entraînent des lésions multiorganiques, et environ trente pourcent des nourrissons diagnostiqués avec CDH ne quittent jamais l’hôpital.2
L’imagerie diagnostique et les dépistages génétiques aident les cliniciens à détecter les maladies congénitales fœtales in utero, mais les modèles permettant d’étudier le développement des organes et la progression de la maladie sont limités. Au cours de la dernière décennie, organoïdes sont devenus une plateforme de plus en plus populaire pour modéliser le fonctionnement des organes et les maladies.3 Cependant, la génération d’organoïdes fœtaux est compliquée par des restrictions éthiques et juridiques sur le prélèvement des tissus humains nécessaires à la génération des mini-organes.
Maintenant, je fais rapport dans Médecine naturelleles chercheurs ont généré organoïdes fœtaux en utilisant des cellules dérivées de liquides amniotiques et trachéaux humains.4 Ces mini-organes offrent une approche mini-invasive pour la modélisation des maladies au cours d’une grossesse active et pourraient éventuellement éclairer le développement d’interventions prénatales personnalisées.
« Avoir accès au tissu fœtal offre la possibilité de modéliser le tissu fœtal pendant que le bébé est encore dans l’utérus », a déclaré Mattia Gerlibiologiste des cellules souches à l’University College London (UCL) et co-auteur de l’étude.
Les scientifiques utilisent des cellules de patients pour générer des organoïdes possédant certaines caractéristiques et fonctions de l’organe modélisé tout en conservant l’empreinte génétique de l’individu. Cependant, bon nombre de ces plateformes nécessitent de longs protocoles de dédifférenciation pour ramener les cellules somatiques dans un état de pluripotence, puis les reprogrammer pour se développer comme un autre type de cellule.5 Contrairement aux organoïdes générés à partir de cellules souches pluripotentes, les organoïdes primaires utilisent des cellules souches ou des cellules progénitrices spécifiques à un tissu et nécessitent donc une manipulation minimale.3 Bien que le domaine des organoïdes soit relativement avancé en termes d’utilisation de tissus adultes, les chercheurs ne peuvent générer des organoïdes fœtaux primaires qu’en utilisant des tissus provenant de grossesses interrompues. « Cela rendait fondamentalement impossible (la génération d’organoïdes) compatible avec la poursuite de la grossesse, et donc dans le cadre d’une médecine personnalisée », a déclaré Gerli. Pour rechercher des sources alternatives de composants organoïdes, Gerli et ses collègues se sont tournés vers le liquide amniotique.
Pendant la gestation, le fœtus flotte dans un bassin protecteur de liquide amniotique.6 Le liquide jaunâtre contient une concoction de nutriments et d’anticorps produits par le parent ainsi que des apports moins glamour du fœtus, notamment de l’urine. Il comprend également des cellules fœtales éliminées au cours du développement, que les médecins peuvent extraire et analyser à la recherche de signes de maladie.
« Historiquement, on pensait que ces cellules étaient des cellules mortes ou des cellules excrétées par la muqueuse de la cavité du liquide amniotique », a déclaré Shaun Kunisaki, chirurgien pédiatrique de l’Université Johns Hopkins qui n’a pas participé à l’étude. La plupart des cellules du liquide amniotique sont épithéliales, mais les scientifiques en savaient très peu sur ces populations cellulaires.3 « Tout a changé lorsque (Gerli) a commencé à examiner au niveau d’une seule cellule ce qui se passait dans le liquide amniotique », a déclaré Paolo De Coppibiologiste des cellules souches et chirurgien pédiatrique à l’UCL et coauteur de l’étude.

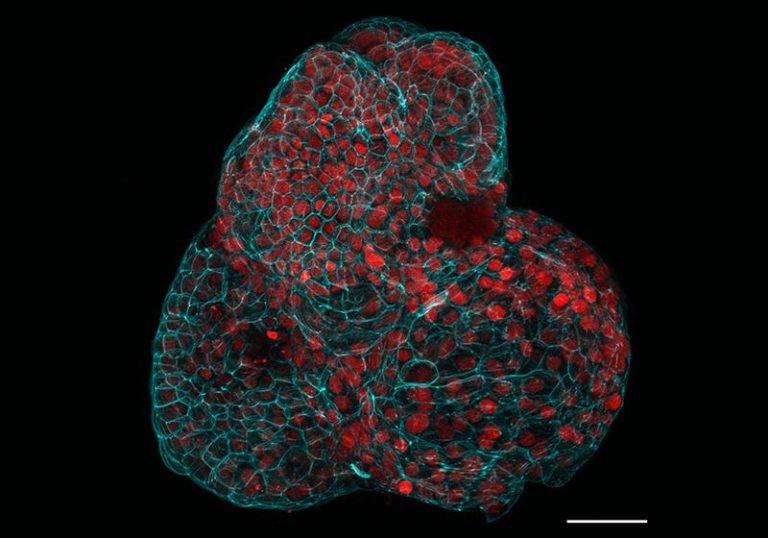
Les organoïdes rénaux générés à partir du liquide amniotique présentaient des structures ressemblant à des tubules rénaux.
Giuseppe Calà, Paolo De Coppi, Mattia Gerli
Gerli et ses collègues ont utilisé le séquençage d’ARN unicellulaire pour caractériser le liquide amniotique de 12 patients et ont découvert des sous-populations de cellules épithéliales qui exprimaient des marqueurs typiques des progéniteurs du poumon, du rein et de l’intestin grêle. Les chercheurs ont cultivé les cellules progénitrices spécifiques aux tissus, leur ont donné un cocktail chimique pour soutenir leur croissance et ont observé leur prolifération, leur différenciation et leur auto-organisation en organoïdes épithéliaux 3D. Les mini-organes partageaient certaines caractéristiques transcriptomiques et protéiques trouvées dans leurs tissus d’origine. Par exemple, les cellules épithéliales pulmonaires qui se sont développées et différenciées en culture présentaient une expression élevée des marqueurs des voies respiratoires par rapport à leurs homologues non différenciées. De même, les organoïdes épithéliaux rénaux expriment des marqueurs associés aux tubules rénaux, qui font partie intégrante du système de filtration des reins.
Bien que le liquide amniotique contienne des cellules provenant d’autres tissus, les chercheurs n’ont pas pu les transformer en organoïdes, ce qui suggère qu’ils manquent de capacités progénitrices. D’autres groupes de recherche ont réussi à cultiver des organoïdes fœtaux à partir de cellules somatiques flottant autour du liquide amniotique, et les mini-organes générés grâce à cette approche sont plus complexes que les modèles développés par De Coppi et son équipe.7 Cependant, les méthodes de reprogrammation prennent jusqu’à 20 semaines pour générer des organoïdes. Si l’objectif est d’utiliser des organoïdes pour éclairer les interventions prénatales, le timing est essentiel.
Pour les cas les plus graves de CDH, les médecins pratiquent une intervention chirurgicale prénatale pour implanter un ballon qui bloque artificiellement la trachée. Cela empêche le liquide pulmonaire de s’échapper, entraînant une accumulation de pression qui favorise le développement des poumons. De Coppi a noté que l’opération est réalisée vers 25 semaines de gestation. Cependant, les médecins ne peuvent éliminer en toute sécurité le liquide amniotique qu’à partir de la 15e semaine environ, ce qui donne aux scientifiques une fenêtre de 10 semaines pour générer des organoïdes spécifiques au patient que les scientifiques pourraient utiliser pour tester des médicaments susceptibles de soutenir davantage la croissance pulmonaire lorsqu’ils sont utilisés parallèlement à des interventions chirurgicales. Parce que les chercheurs utilisent des cellules progénitrices qui ne nécessitent aucune reprogrammation, ils peuvent générer les organoïdes du patient en quatre à six semaines. « Nous perdons de la complexité, mais nous gagnons du temps », a déclaré Gerli.
Pour explorer l’utilité de leur plateforme dans la modélisation des maladies, De Coppi et son équipe ont généré des organoïdes pulmonaires en utilisant le liquide amniotique de fœtus atteints de CDH. Les mini-poumons CDH récapitulaient certaines caractéristiques de la maladie, comme une élévation du récepteur de l’angiotensine 2 (À 2 HEURES) l’expression du gène. Parce qu’ils ont collecté du liquide amniotique avant et après une intervention chirurgicale, les chercheurs ont pu comparer les organoïdes générés à partir des deux moments. De Coppi et son équipe ont observé une réduction de l’expression du marqueur épithélial progéniteur SRY-box facteur de transcription 9 (SOX9) après la procédure, indiquant la maturation des tissus. Cependant, en raison de la taille limitée de l’échantillon, ils n’ont pas effectué d’analyses par sujet.
Bien que les cellules éliminées capturées dans le liquide amniotique offrent une méthode peu invasive pour acquérir des tissus fœtaux, Kunisaki a déclaré : « La question de savoir si (les cellules) reflètent fidèlement ce qui se passe au sein du développement fœtal a toujours été un peu controversée. » Kunisaki a également noté que l’étude se limite à trois types de cellules, mais que c’est souvent l’interaction entre diverses populations cellulaires qui est importante pour modéliser le développement des organes. « C’est un peu limité en termes de cela, mais quoi qu’il en soit, les résultats qu’ils présentent sont vraiment prometteurs », a déclaré Kunisaki.
« L’autre possibilité que (ces organoïdes) s’ouvrent est d’étudier le développement du poumon à un stade où l’accès à ce tissu est très difficile », a déclaré De Coppi. Compte tenu des diverses restrictions légales sur l’accès aux tissus fœtaux, en particulier au-delà de 22 semaines de gestation, Gerli a déclaré que leur plateforme pourrait fournir aux scientifiques un moyen peu invasif de surveiller le développement de ces tissus aux stades ultérieurs de la grossesse. « Cette technologie apporte une avancée assez importante », a déclaré Gerli.
Les organoïdes nécessitent encore une validation clinique, mais Gerli et De Coppi espèrent que leur modèle bénéficiera aux patients à terme. « L’objectif est de pouvoir réellement utiliser les organoïdes comme plate-forme pour la modélisation des maladies et les tests de médicaments pour ces patients », a déclaré Gerli.
Quelques médicaments sont disponibles dans le commerce, mais les patients réagissent différemment aux traitements, qui ne sont actuellement administrés qu’après la naissance. L’administration prénatale de ces thérapies pourrait favoriser la formation adéquate du diaphragme plus tôt dans le développement. « C’est une possibilité vraiment intrigante basée sur ce type de technologie », a déclaré Kunisaki.
Les références
- Zani A, et al. Hernie diaphragmatique congénitale. Nat Rev Dis Amorces. 2022;8(1):37.
- Politis MD, et al. Prévalence et mortalité chez les enfants atteints de hernie diaphragmatique congénitale : une étude multipays. Ann Épidémiol. 2021;56:61-69.e3.
- Calà G, et al. Modèles d’organoïdes humains primaires : progrès actuels et étapes clés. Front Bioeng Biotechnologie. 2023;11:1058970.
- Gerli MFM, et al. Dérivation prénatale guidée unicellulaire d’organoïdes épithéliaux fœtaux primaires à partir de liquides amniotiques et trachéaux humains. Médecine naturelle. 2024;30(3):875-887.
- Kim J, et coll. Organoïdes humains : systèmes modèles pour la biologie humaine. Nat Rev Mol Cell Biol. 2020;21(10):571-584.
- Underwood MA, et al. Liquide amniotique : plus seulement l’urine fœtale. J Périnatol. 2005;25(5):341-348.
- Kunisaki SM, et al. Organoïdes pulmonaires dérivés de cellules souches pluripotentes induites par l’homme dans un modèle ex vivo de poumon fœtal de hernie diaphragmatique congénitale. Cellules souches Transl Med. 2021;10(1):98-114.