CL’alcium déclenche une variété de processus biologiques, mais certains des mécanismes en amont régulant sa libération ont échappé aux scientifiques pendant des décennies. Aujourd’hui, une collaboration internationale a conduit à la publication de deux articles dans Signalisation scientifique sur le mécanismes qui ouvrent les vannes du calcium, révélant un itinéraire potentiel aux nouvelles thérapies tout en réglant un débat en cours de route.1,2
Les canaux ioniques exprimés sur les organites agissent comme des gardiens, contrôlant le passage du calcium des réserves internes vers le cytosol. L’acide nicotinique adénine dinucléotide phosphate (NAADP) est l’une des nombreuses clés qui ouvrent la porte. Découvert pour la première fois à la fin des années 1980 oeufs d’oursin et trouvé plus tard dans cellules de mammifèresle NAADP déclenche la libération de calcium réserves lysosomales via l’activation de canaux ioniques, en particulier un canal à deux pores (TPC).3-6
« Le NAADP est un second messager très curieux », a déclaré Jonathan Marchant, biologiste cellulaire au Medical College of Wisconsin et co-auteur des articles. Bien qu’il s’agisse d’un puissant déclencheur de la libération de calcium, les chercheurs n’ont jamais découvert de site de liaison direct, ou trou de serrure, pour le NAADP sur le TPC. Ensuite, deux articles publiés en 2021, dont un de l’équipe de Marchant, a fourni un lien manquant.7,8 Les études ont révélé l’identité moléculaire d’une protéine, l’homologue 2 associé aux microtubules de Jupiter (JPT2), qui facilite la liaison du NAADP au TPC. Si le NAADP est le manche de la clé, alors JPT2 est comme la lame qui s’insère dans le TPC pour ouvrir ses vannes.
Ajoutant à l’enthousiasme dans ce domaine, un autre article publié plus tard cette année-là a identifié une autre lame : la protéine protéine like-Sm 12 (LSM12)… qui reliait le NAADP au PTC.9 « Les gens plaisantent toujours en disant qu’on attend qu’un bus arrive, et que trois bus arrivent en même temps », a déclaré Marchant. Suite à l’émergence de deux régulateurs prometteurs du NAADP, de nombreux chercheurs ont remis en question les redondances potentielles, suggérant qu’une protéine pourrait être plus importante que l’autre.
Voir également « Les scientifiques découvrent les principales voies utilisées par les cellules pour réparer les lysosomes qui fuient»
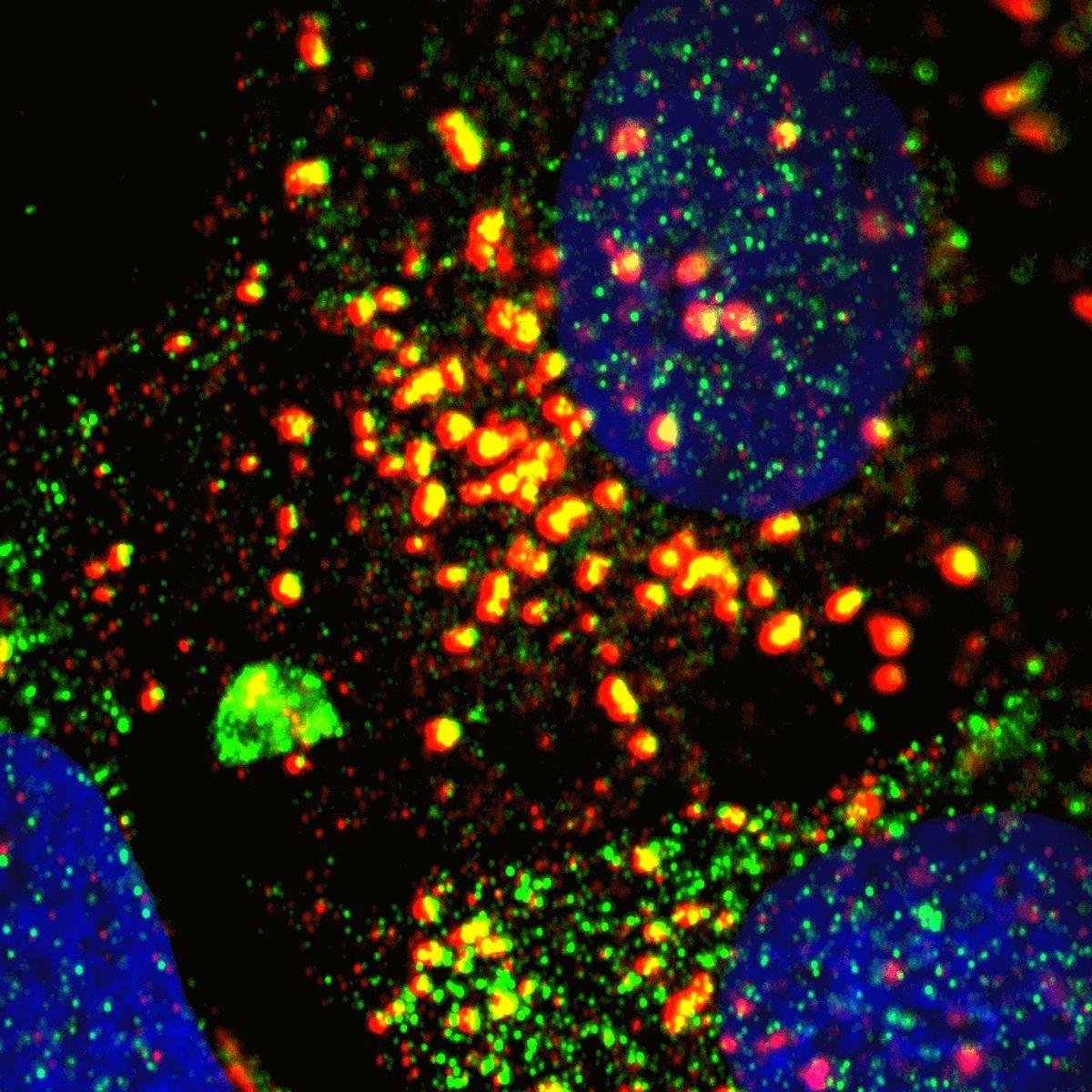
Deux protéines, dont LSM12 (en vert), négocient l’interaction entre le NAADP et le canal ionique TPC pour libérer le calcium des lysosomes (marqueur LAMP1, en rouge).
Qianru Mu et Sandip Patel
Pour déterminer quelle protéine était la véritable lame clé du NAADP, Marchant, en collaboration avec un co-auteur et chercheur postdoctoral Gihan Gunaratnéa effectué une comparaison côte à côte étroitement contrôlée de JPT2 et LSM12.1
Pour cela, ils ont examiné trois critères : la sélectivité, le caractère contraignant et l’essentialité. Premièrement, JPT2 et LSM12 présentaient une liaison sélective et de haute affinité au NAADP, telle que mesurée par les tests de liaison des radioligands et interférométrie de biocouche (BLI). Cette dernière est une technique de biodétection optique qui donne un aperçu de la cinétique de liaison du NAADP. Plonger une sonde recouverte de JPT2 ou de SLM12 biotinylé dans des puits contenant du NAADP a permis aux chercheurs de suivre la liaison des protéines en temps réel. Comparés aux puits contenant du NADP, une molécule similaire qui ne déclenche pas la libération de calcium, JPT2 et LSM12 ont démontré une sélectivité significativement plus élevée pour le NAADP.
Ensuite, pour vérifier si les deux protéines s’intègrent également dans le TPC, l’équipe de Marchant a réalisé des expériences d’immunoprécipitation. Ils ont constaté que les deux protéines interagissaient avec le TPC de manière indépendante. Enfin, des expériences knock-out in vitro ont révélé la nécessité de JPT2 et de LSM12 non seulement pour débloquer la signalisation calcique, mais également pour d’autres fonctions cellulaires dépendantes du NAADP. Lorsque les chercheurs ont ajouté du NAADP à des cellules dépourvues de JPT2 ou de LSM12, ils n’ont pas observé d’augmentation du calcium cytoplasmique, alors que les cellules knock-out de JPT1 présentaient un calcium élevé. L’activité TPC joue également un rôle dans le trafic viral dans le système endolysosomal. Lorsque Marchant et son équipe ont surveillé le transit de différentes protéines de pointe du coronavirus dans les cellules, ils ont observé une réduction de l’infection dans les cellules dépourvues de JPT2 et de LSM12. Ces résultats suggèrent que les protéines liant le NAADP, en plus de déclencher la libération de calcium, jouent un rôle essentiel dans la médiation de la fuite virale des lysosomes.
« Ce qui est remarquable dans ce dernier article du groupe de Marchant, c’est qu’il semble suggérer qu’il faut les deux JTP2 et LSM12 pour lier NAADP et interagir avec le canal pour l’ouvrir », a déclaré Antoine Galione, pharmacologue à l’Université d’Oxford qui n’a pas participé à l’étude. « Une seule protéine de liaison chargée en NAADP ne suffit pas, ce qui constitue en réalité une régulation assez contrôlée. » Ainsi, TPC dispose d’un système de double verrouillage pour contrôler les activités dépendantes du NAADP.
TPC est tout aussi curieux que NAADP. Les scientifiques ont longtemps cru que la sélectivité ionique était une caractéristique immuable des canaux ioniques. Cependant, les scientifiques ont découvert que le TPC régule également le sodium via la liaison directe du phosphatidylinositol 3,5-bisphosphate (PI(3,5)P2).
Sandip Patelbiologiste cellulaire à l’University College London et co-auteur des articles, a contribué à la découverte deux petites molécules qui déclenchent la libération de calcium ou de sodium du TPC, fournissant ainsi un moyen synthétique de réguler l’activité des canaux.dix Dans le document d’accompagnement, Patel s’est associé à Marchant et Taufiq Rahmanpharmacologue à l’Université de Cambridge pour tester si l’agoniste synthétique qui imitait le NAADP nécessitait de la même manière que les deux protéines évoquent des signaux calciques.2
Voir également « Compétence cellulaire : rendre l’ADN recombinant accessible»
Lorsque les chercheurs ont supprimé JPT2 ou LSM12 des cellules, ils ont découvert que le mimétique du NAADP évoquait toujours des signaux de calcium, fournissant les premiers indices que cette petite molécule fonctionne à l’aide d’un système de verrouillage et de clé alternatif au NAADP. Dans un précédent étudel’équipe de Patel a découvert que NAADP et PI(3,5)P2 en synergie pour augmenter les signaux calciques, ils ont donc testé les exigences du TPC PI(3,5)P connu2 site de liaison pour la libération évoquée de calcium.11 À leur grande surprise, la mutation du PI(3,5)P2 le site de liaison a bloqué les effets du NAADP, mais pas le mimétique synthétique.
« C’était une étrange convergence entre deux molécules complètement différentes qui activent le canal et ont deux sorties complètement différentes – l’une liée au calcium, l’autre au sodium – et pourtant elles semblent converger vers ce site de liaison commun », a déclaré Patel.
Bien que les chercheurs ne comprennent pas encore complètement comment cette clé d’or mimétique du NAADP active le TPC, ils ont réalisé des expériences initiales de mutagenèse dirigée sur un site qui pointent vers une partie du canal, la région cryptique de détection de tension, qui était nécessaire aux actions du canal. mimétique mais pas NAADP.
Ces expériences mettent en évidence des différences mécanistiques entre le NAADP et le mimétique, mais Galione a noté une limitation de la mutagenèse. La mutation protéique d’un site ou d’un domaine spécifique peut avoir des effets étendus sur le comportement des canaux, ce qui rend souvent difficile l’attribution d’un rôle spécifique à un acide aminé donné. « Malgré ces préoccupations, certaines de ces protéines mutées sont utiles pour tenter de disséquer les modalités de régulation des canaux », a déclaré Galione.
Il est de plus en plus évident que PTC important ou dysfonctionnel dans maladies infectieuses, stéatose hépatique et maladie de Parkinson.12 « Peut-être pouvons-nous contourner ces protéines de liaison avec nos médicaments », a déclaré Patel. « En d’autres termes, si les protéines de liaison étaient défectueuses d’une manière ou d’une autre, disons en cas de maladie, alors parce que nous avons découvert que ces activateurs chimiques peuvent contourner ces protéines de liaison, nous pourrions potentiellement corriger tout défaut avec ces médicaments. »
En plus d’explorer le potentiel médicamenteux de ces canaux et de ces protéines de liaison, Marchant est ravi d’analyser comment, au niveau moléculaire, les deux protéines interagissent avec le NAADP et le TPC, et même entre elles. « Il y a des propriétés surprenantes de ces protéines que nous n’avons pas encore bien compris », a déclaré Marchant.
Les références
- Gunaratne GS, et al. Activation convergente de canaux à deux pores médiée par les protéines de liaison au NAADP JPT2 et LSM12. Signal scientifique. 2023;16(799):eadg0485.
- Saito R, et al. Activation convergente de Ca2+ perméabilité dans le canal 2 à deux pores par des voies moléculaires distinctes. Signal scientifique. 2023;16(799):eadg0661.
- Clapper DL, et al. Les métabolites nucléotidiques de la pyridine stimulent la libération de calcium par les microsomes des œufs d’oursin désensibilisés au triphosphate d’inositol. J Biol Chem. 1987;262(20):9561-9568.
- Cancela JM, et al. Coordination du Ca induit par l’agoniste2+-modèles de signalisation par NAADP dans les cellules acineuses pancréatiques. Nature. 1999;398(6722):74-76.
- Churchill GC, et coll. Le NAADP mobilise le Ca2+ à partir de granules de réserve, organites liés aux lysosomes, dans les œufs d’oursin. Cellule. 2002;111(5):703-708.
- Calcraft PJ, et coll. Le NAADP mobilise le calcium des organites acides via des canaux à deux pores. Nature. 2009;459(7246):596-600.
- Gunaratne GS, et al. Exigence essentielle pour JPT2 dans le Ca évoqué par le NAADP2+ signalisation. Signal scientifique. 2021;14(675):eabd5605.
- Roggenkamp HG, et al. HN1L/JPT2 : une protéine de signalisation qui relie la génération de NAADP à la formation du microdomaine Ca2+. Signal scientifique. 2021;14(675):eabd5647.
- Zhang J et coll. Lsm12 est un récepteur NAADP et une protéine régulatrice de canaux à deux pores nécessaire à la mobilisation du calcium à partir des organites acides. Nat Commun. 2021;12:4739.
- Gerndt S, et al. La commutation de la sélectivité ionique médiée par un agoniste dans TPC2 favorise différentiellement la fonction lysosomale. eLife. 2020;9 :e54712.
- Yuan Y, et al. Flux de cations séparés par biais TPC2 Ca2+ signalisation via les lysosomes. Nat Commun. 2022;13:4481.
- Patel S. Fonction et dysfonctionnement des canaux à deux pores. Signal scientifique. 2015;8(384):eaab3314.



