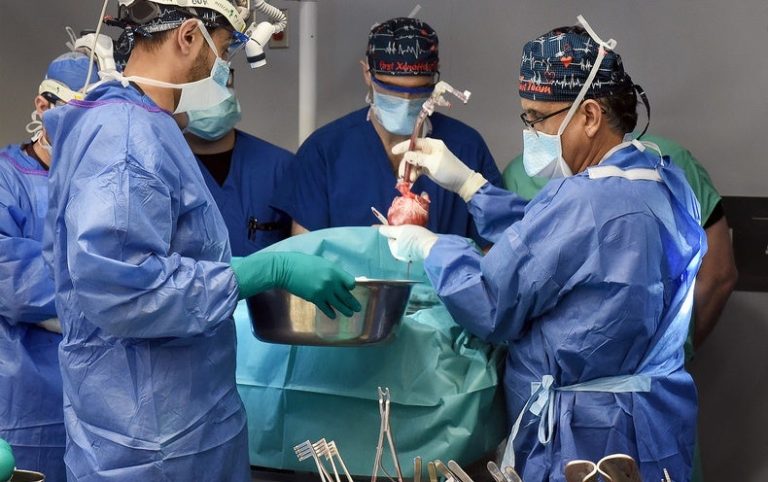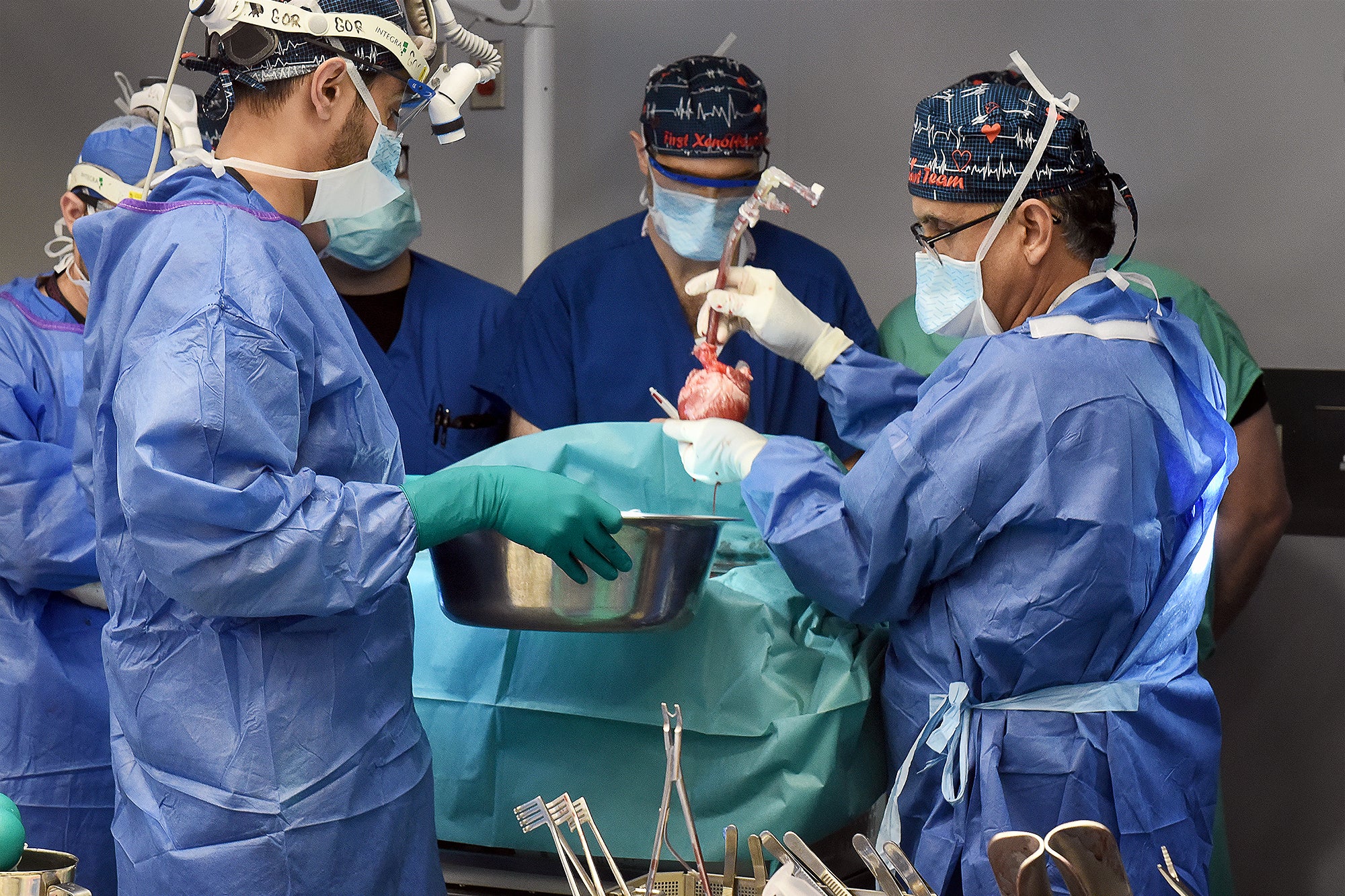
Note de l’éditeur (11/1/23) : Lawrence Faucette, receveur d’une transplantation cardiaque de porc, est décédé le 30 octobre, selon le centre médical de l’Université du Maryland, où Faucette a reçu l’opération et les soins post-transplantation. L’équipe médicale a signalé que Faucette présentait des signes de rejet d’organe. Il avait vécu près de six semaines après avoir reçu un cœur de porc génétiquement modifié.
À la fin du mois dernier, une équipe de chercheurs de la faculté de médecine de l’Université du Maryland a transplanté un cœur de porc génétiquement modifié chez une personne – la deuxième opération chirurgicale de ce type jamais tentée – et cela l’a maintenu en vie au cours des dernières semaines. Le patient, Lawrence Faucette, 58 ans, a subi cette procédure hautement expérimentale dans le cadre d’un parcours « d’usage compassionnel », dans lequel la Food and Drug Administration des États-Unis autorise une thérapie non approuvée lorsqu’une personne est gravement malade ou mourante et n’a pas d’autres options disponibles. Faucette n’était pas éligible à une transplantation cardiaque humaine conventionnelle parce qu’il souffrait d’une maladie vasculaire périphérique et d’autres complications, ce qui réduisait les chances de succès.
À la mi-octobre, Faucette continuait sa convalescence et suivait une thérapie physique. « Il a traversé une période difficile », a cependant déclaré à l’époque Bartley Griffith, chirurgien à l’Université du Maryland, qui avait pratiqué l’intervention de Faucette ainsi que la précédente. Selon Griffith, Faucette vivait chez lui lorsque la FDA a approuvé l’opération pour la première fois, mais il a ensuite été hospitalisé avec du liquide dans les poumons. Puis il a subi un arrêt cardiaque la nuit précédant l’opération. Pourtant, jusqu’à présent, il avait bien réagi à la greffe et était assis sur une chaise deux jours plus tard.
Plus de 100 000 personnes sont en attente d’une greffe d’organe-la plupart d’entre eux sont destinés aux reins-c’est pourquoi les chercheurs explorent depuis longtemps xénotransplantation: transplanter des organes d’autres espèces chez l’homme. Pour empêcher le système immunitaire humain d’attaquer ces organes extraterrestres, les scientifiques ont commencé à élever des porcs donneurs génétiquement modifiés dépourvus de certains gènes ou auxquels d’autres gènes ont été ajoutés.
Au cours des deux dernières années, des xénotransplantations porcines ont été testées dans les deux primates non humains et des humains décédés, mais le but ultime est de mener des essais cliniques sur des humains à plus grande échelle. Les résultats de la récente transplantation pour usage compassionnel influenceront probablement la décision de la FDA de savoir si et quand autoriser de tels essais. De nombreux chercheurs espèrent que cela pourrait se produire d’ici un an ou deux.
« J’adorerais voir le cœur (xénotransplantation) faire l’objet d’un essai clinique l’année prochaine et le rein (essais de xénotransplantation) peu de temps après », déclare Jayme Locke, directeur de la division de transplantation à l’Université d’Alabama à Birmingham, qui n’a pas participé à l’étude. dernière chirurgie expérimentale. Locke et ses collègues ont réalisé plusieurs xénotransplantations rénales chez des humains ayant subi une mort cérébrale. « La FDA détient ces cartes, et je pense que cela dépendra vraiment de son seuil de tolérance au risque », dit-elle. «Mais j’ai bon espoir. Je pense que la FDA veut que cela se produise.
En janvier 2022, Griffith et son équipe de l’Université du Maryland ont transplanté un cœur de porc génétiquement modifié de la société Revivicor chez un patient, David Bennett, Sr., qui a vécu deux mois avant que son cœur ne décède. On a découvert plus tard que le cœur était infecté par un virus porcin qui avait échappé au dépistage, bien que d’autres facteurs puissent également avoir joué un rôle dans l’échec de la greffe et la mort de Bennett.
« Nous avons réussi un assez bon élan avec le ballon la première fois, et nous pensons que nous sommes très proches d’un succès prolongé », a déclaré Griffith. Il y a eu des circonstances imprévues dans cette première xénotransplantation qui ont pu affecter son résultat, comme le virus porcin qui a ensuite été découvert dans le cœur, ajoute Griffith. Depuis lors, son équipe et d’autres ont développé de meilleures méthodes pour tester ces virus.
La famille de Bennett est heureuse qu’il ait pu participer. « Il a vécu deux mois et nous avons pu passer plus de temps avec lui. J’en suis donc reconnaissant », déclare son fils, David Bennett, Jr., qui espère que l’opération de Faucette réussira. « Je suis reconnaissant pour chaque rêve et espoir et pour chaque personne impliquée dans cela et pour la capacité qu’il a d’aller de l’avant. »
Une différence majeure entre la première et la deuxième chirurgie est que, même si Faucette était considéré comme en phase terminale, il était en bien meilleure santé que Bennett au moment de son intervention. Contrairement à Bennett, Faucette vivait chez lui peu de temps avant la greffe et était beaucoup plus mobile, selon Muhammad Mohiuddin, directeur du programme de xénotransplantation cardiaque à la faculté de médecine de l’Université du Maryland, qui gère le régime anti-rejet de greffe de Faucette. .
D’autres chercheurs conviennent que Faucette était un candidat plus approprié pour une procédure aussi nouvelle. « Mon sentiment général est que ce patient était en bien meilleure forme que le patient précédent », déclare Nader Moazami, chirurgien de transplantation cardiothoracique à NYU Langone Health, qui n’a pas participé à la greffe de Faucette. « Une partie du problème lorsque nous avons un patient qui est très, très malade – et que vous vous lancez dans une xénotransplantation expérimentale, où nous ne savons toujours pas exactement quelle combinaison d’agents immunosuppresseurs est la bonne – est que ces patients sont très enclins à développer diverses complications. L’année dernière, Moazami et ses collègues ont transplanté des cœurs de porc génétiquement modifiés chez deux personnes souffrant de mort cérébrale, et les organes ont bien fonctionné pendant plusieurs jours.
Les procédures de Bennett et de Faucette utilisaient des médicaments immunosuppresseurs standards en plus d’un médicament expérimental. Avec Bennett, l’équipe a utilisé un anticorps expérimental appelé KPL-404, qui bloque un récepteur appelé CD40 qui active les réponses immunitaires des cellules B et T de l’hôte, ce qui peut conduire au rejet d’un organe étranger. Avec Faucette, l’équipe a utilisé un médicament appelé tegoprubart, qui a été développé par Eledon Pharmaceuticals et bloque la molécule, ou ligand, qui se lie au CD40. Tegoprubart a été testé dans le cadre d’essais cliniques de phase 2 pour les greffes de rein humain, mais n’est pas encore approuvé par la FDA.
L’équipe travaille également avec des laboratoires internationaux qui utilisent l’intelligence artificielle pour évaluer les biopsies du tissu cardiaque de Faucette, une évaluation qui, selon Griffith, pourrait détecter les premiers signes de rejet de tissu.
La FDA a suivi de près le cas de Faucette, qui pourrait éclairer la décision de l’agence d’approuver les essais cliniques de xénotransplantation. Locke pense que les premiers essais porteront probablement sur le cœur et non sur les reins, car la dialyse peut maintenir en vie les personnes atteintes d’une maladie rénale pendant plusieurs années. Il n’existe pas de substitut comparable à la fonction cardiaque. La dialyse reste cependant une option imparfaite et Locke espère que les xénotransplantations rénales seront la prochaine étape. « Je pense qu’il existe une perception erronée répandue selon laquelle la dialyse est une alternative appropriée, mais ce n’est pas le cas », déclare Locke. « Les gens peuvent vivre un peu plus longtemps grâce à la dialyse » qu’avec des thérapies cardiaques prolongeant la vie, dit-elle, mais la dialyse ne peut pas remplacer la fonction rénale à long terme. Seules les greffes peuvent faire cela. « Nous disposons désormais d’une source alternative d’organes qui, je crois sincèrement, est meilleure que la dialyse », dit-elle. « Et il est temps de pouvoir tester cela. »