Les scientifiques ont trouvé un moyen de faire exploser les « portes » qui mènent au cœur des tumeurs cancéreuses, les ouvrant ainsi grandes aux traitements médicamenteux.
La stratégie fonctionne en déclenchant une « bombe à retardement » sur les cellules qui tapissent les vaisseaux sanguins associés à une tumeur.
Ces vaisseaux contrôlent l’accès au tissu tumoral et jusqu’à ce qu’ils soient ouverts, les cellules immunitaires artificielles ne peuvent pas facilement accéder au tissu tumoral. cancer pour le combattre.
La bombe à retardement présente sur ces cellules est en réalité un récepteur de « mort », appelé Fas (ou CD95).
Lorsqu’il est activé par le bon anticorpscela déclenche la mort programmée de cette cellule.
Scientifiques de l’Université de Californie à Davis (UCD) et de l’Université d’Indiana argumenter que jusqu’à récemment, Fas était « sous-évalué dans l’immunothérapie du cancer ». À ce jour, pas un seul Fas anticorps est parvenu à essais cliniques.
Lors d’expériences récentes utilisant des modèles murins et des lignées cellulaires humaines, les scientifiques de l’UCD ont enfin identifié des anticorps qui, lorsqu’ils sont attachés aux récepteurs Fas, déclenchent efficacement l’auto-implosion.
« Les efforts précédents pour cibler ce récepteur ont échoué. Mais maintenant que nous avons identifié cet épitope, il pourrait y avoir une voie thérapeutique pour cibler Fas dans les tumeurs », explique immunologiste et auteur principal de l’étude Jogender Tushir-Singh.
L’anticorps qui se lie à cela épitope (une partie spécifique du récepteur de mort), représente essentiellement le kill switch de la cellule.
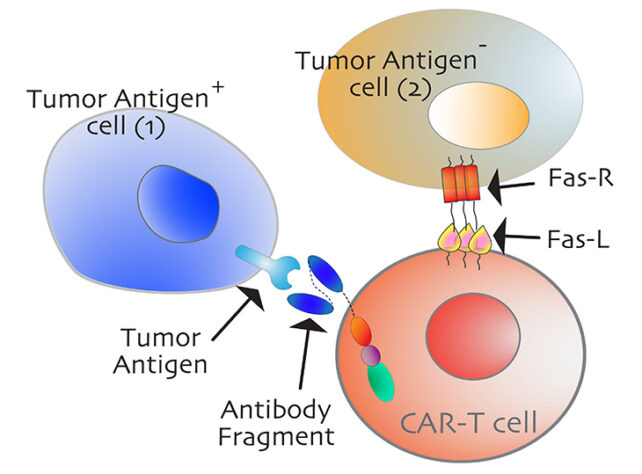
Une fois ce point de contrôle immunitaire ouvert, d’autres thérapies anticancéreuses, comme la thérapie CAR-T, peuvent accéder à davantage de leurs cibles, qui sont souvent regroupées et cachées dans la tumeur.
Thérapie CAR-T agit en programmant les globules blancs d’une personne, appelés lymphocytes T, pour qu’ils se lient à des types spécifiques de cellules cancéreuses et les attaquent.
Cependant, ces cellules immunitaires adaptées ne peuvent généralement pas dépasser les cellules « spectateurs » dépourvues des antigènes reconnaissables habituellement utilisés pour cibler les cellules tumorales.
En conséquence, la thérapie CAR-T n’a été approuvée que pour traiter les cancers du sang ou la leucémie. Il ne parvient pas à fournir un succès constant contre les tumeurs solides.
« On les appelle souvent tumeurs froides parce que les cellules immunitaires ne peuvent tout simplement pas pénétrer dans les microenvironnements pour produire un effet thérapeutique », explique Tushir-Singh.
« Peu importe la façon dont nous concevons les anticorps activant les récepteurs immunitaires et les cellules T s’ils ne peuvent pas se rapprocher des cellules tumorales. Par conséquent, nous devons créer des espaces pour que les cellules T puissent s’infiltrer. »
Dans des expériences récentes à l’UCD, les scientifiques ont développé deux anticorps artificiels qui étaient « extrêmement efficaces » pour se lier aux récepteurs Fas et provoquer l’auto-implosion des cellules voisines. Cela était vrai dans les modèles de cancer de l’ovaire et dans de nombreuses autres lignées de cellules tumorales testées en laboratoire.
Le ligand Fas développé par les chercheurs a pu engager deux parties critiques du récepteur Fas, qui, selon les chercheurs, devraient être étudiées plus en détail. Ces parties ont le potentiel de devenir de futures cibles médicamenteuses.
Si les cellules CAR-T pouvaient un jour être conçues pour cibler également ces parties réceptrices sur les cellules témoins, la thérapie pourrait être beaucoup plus efficace contre les tumeurs.
« Nous devrions connaître le statut Fas d’un patient – en particulier les mutations autour de l’épitope découvert – avant même d’envisager de lui administrer CAR-T », dit Tushir-Singh.
« Il s’agit d’un marqueur définitif de l’efficacité du traitement par des tiers de la thérapie CAR-T. Mais plus important encore, cela ouvre la voie au développement d’anticorps qui activent Fas, tuent sélectivement les cellules tumorales et soutiennent potentiellement la thérapie cellulaire CAR-T dans les tumeurs solides. »
L’étude a été publiée dans Mort cellulaire et différenciation.